Bienvenida
¿Cómo es que los organismos, los diferentes componentes de los sistemas biológicos, y los fenómenos naturales que suceden a nuestro alrededor, tienen la energía necesaria para llevar a cabo diferentes actividades?, ¿de qué forma se obtiene? y ¿cómo es que se pierde?, o ¿qué pasa, por qué disminuye la energía? La forma sencilla de explicar ésto es mediante las leyes de la termodinámica, una ciencia auxiliar de la Física que describe la forma en que se lleva a cabo la transferencia e intercambio de materia, los diferentes tipos de energía entre los sistemas y el entorno. La explicación de cómo es que se llevan a cabo los fenómenos que existen en la naturaleza (físicos, químicos, mecánicos), y en donde cierta parte de la energía se convierte en calor, se puede hallar mediante las cuatro leyes de la termodinámica: ley cero del equilibrio térmico, 1a ley de la conservación de la energía, 2a ley de la energía transferida de un sistema a otro, y 3a ley que trata del cero absoluto.

Figura 1. Termodinámica
Se podrán resolver incógnitas de cómo se mueven los autos después de haberles adicionado combustible (gasolina), cómo se fabrican las proteínas en las células de los organismos, por qué las luciérnagas generan cierta luz de noche, cómo fabrican estructuras las células, o por qué se mueven los planetas.
En sistemas físicos como un motor, una máquina de vapor y algunos fenómenos físicos naturales, es fácil aplicar y diferenciar las leyes de la termodinámica, ya que son cíclicos, reversibles, adiabáticos, con presión, temperatura y volumen constante; es decir funcionan como máquinas técnicas. Por su parte, los sistemas biológicos en los seres vivos presentan mecanismos complejos, irreversibles y diabáticos en donde la presión y temperatura permanecen constantes.
La energía se presenta en diferentes tipos y se involucra en diferentes procesos donde se transfiere calor y se realiza trabajo; por ejemplo, cuando una persona ingiere alimentos y los trasforma químicamente en energía calorífica útil para realizar algún trabajo. Algunos procesos en los que intervienen las leyes de la termodinámica en los seres vivos son en el crecimiento, la oxidación de grasas, la respiración, defecación, proceso de fecundación, desarrollo embrionario, envejecimiento, sudoración, correr, nadar, descansar, trabajar, caminar, estudiar, cortejar, y un sinfín más que te puedas imaginar.
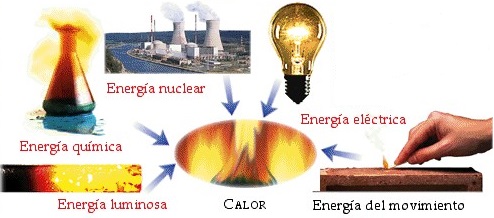
Figura 2. Tipos de energía
Competencia específica
Analizar las leyes de la termodinámica para determinar los efectos térmicos de las reacciones químicas dentro de los sistemas biológicos por medio de los conceptos de entropía y entalpia.
Logros
- Identificar la función de los carbohidratos en las reacciones bioquímicas celulares.
- Diferenciar entre las principales rutas metabólicas de los carbohidratos.
- Explicar las reacciones que se desarrollan en cada una de las fases de la glucólisis.
- Distinguir los puntos y mecanismos de regulación de la glucólisis.
- Comparar la vía de síntesis con la de degradación de la glucosa.
- Catalogar los distintos tipos de fermentaciones y sus aplicaciones.
- Explicar las reacciones que se llevan a cabo en el ciclo de Krebs, así como su regulación.
Cierre
Ahora sabes que de la relación existente entre materia y energía depende la continuidad y la estabilidad del universo entero. Es a través de los flujos de energía y de las transformaciones de materia en energía y viceversa que el universo se mueve y la vida existe. Todos los procesos que tienen lugar en el universo, incluyendo los biológicos, que son de nuestro especial interés, están gobernados por las leyes de la termodinámica de manera directa o indirecta. De ahí la importancia que tiene el estudio de esta ciencia. Podemos decir que conocer los procesos termodinámicos es conocer la vida misma.
Tras haber cursado esta asignatura habrás adquirido bases sólidas que te permitirán continuar tus estudios sobre los procesos relacionados con el balance de energía. Estas bases, a su vez, te facultarán para proponer nuevas alternativas en el empleo de la termodinámica en el área de la biotecnología donde te desempeñes. Felicidades.
Fuentes de consulta
Básica
- Ball, D. W. (2004). Fisicoquímica. México D.F.: International Thomson Editores.
- Brown, T. L., May, H. & Bursten, B. (1998). Química, la ciencia central. 7a ed. México: Pearson.
- Campbell, A. N., Mitchell, G. L. y Reece, B. J. (2001). Biología, conceptos y relaciones. 3a ed. Naucalpan, Edo de México: Pearson. Addison-Wesley.
- Castellan, G. W. (1998). Fisicoquímica. 2a. ed. Estado de México: Addison-Wesley Longman.
- Chang, R. (2008). Fisicoquímica. 3a. ed. México, D. F. McGraw-Hill Interamericana.
- Chang, R. y College, W. (2002). Química. 7a. ed. México, D.F. Mc Graw-Hill.
- Hewitt P. (1999). Conceptos de física. Limusa. México.
- Kotz J., Treichel P., Weaber G. (2005) Química y reactividad química. 6a. ed. Thomson. México.
- Maron S.H. y Prutton C. F. (2003). Fundamentos de fisicoquímica. México, D.F. Limusa.
- Morris G. J. (2001). Fisicoquímica para biólogos. Barcelona, España. Reverté S. A.
- Solomon E. P., Berg L. R y Martin W. D. (2008). Biología. 8a. ed México, D.F. McGraw-Hill Interamericana.
Alternativa
- Castellan, Gilbert. (2008). Fisicoquímica. 2a. ed. Estado de México. Addison-Wesley Longman. México S.A. de C.V.
- Chang, R. (2008). Fisicoquímica. 3a. ed. México, D. F. McGraw-Hill Interamericana.
- Engel, Thomas. (2007). Introducción a la fisicoquímica: termodinámica. Pearson.